| نیتروژن → اکسیژن ← فلوئور |
-
↑
O
↓
S |
|
|
| ظاهر |
|---|
Colorless gas; pale blue liquid. Oxygen bubbles rise in this rotated photo of liquid oxygen.


Spectral lines of oxygen |
| ویژگیهای کلی |
|---|
| نام, نماد, عدد |
اکسیژن, O, 8 |
|---|
| تلفظ به انگلیسی |
/ˈɒksɨdʒɨn/ OK-si-jin |
|---|
| نام گروهی برای عناصر مشابه |
نافلزات, کالکوژنs |
|---|
| گروه، تناوب، بلوک |
۱۶, ۲, p |
|---|
| جرم اتمی استاندارد |
15.9994 g·mol−۱ |
|---|
| آرایش الکترونی |
1s2 2s2 2p4 |
|---|
| الکترون به لایه |
2, 6 (تصویر) |
|---|
| ویژگیهای فیزیکی |
|---|
| حالت |
گاز |
|---|
| چگالی |
(0 °C, 101.325 kPa)
1.429 g/L |
|---|
| چگالی مایع در b.p. |
1.141 g·cm−۳ |
|---|
| نقطه ذوب |
54.36 K, -218.79 °C, -361.82 °F |
|---|
| نقطه جوش |
90.20 K, -182.95 °C, -297.31 °F |
|---|
| نقطه بحرانی |
154.59 K, 5.043 MPa |
|---|
| گرمای همجوشی |
(O2) 0.444 kJ·mol−1 |
|---|
| گرمای تبخیر |
(O2) 6.82 kJ·mol−1 |
|---|
| ظرفیت گرمایی |
(O2)
29.378 J·mol−۱·K−۱ |
|---|
| فشار بخار |
|---|
| فشار (پاسکال) |
۱ |
۱۰ |
۱۰۰ |
۱k |
۱۰k |
۱۰۰k |
| دما (کلوین) |
|
|
|
61 |
73 |
90 |
|
| ویژگیهای اتمی |
|---|
| وضعیت اکسید شدن |
2, 1, −1, −2
(neutral oxide) |
|---|
| الکترونگاتیوی |
3.44 (مقیاس پاولینگ) |
|---|
انرژیهای یونیزه شدن
(more) |
1st: 1313.9 kJ·mol−1 |
|---|
| 2nd: 3388.3 kJ·mol−1 |
| 3rd: 5300.5 kJ·mol−1 |
| شعاع کووالانسی |
66±2 pm |
|---|
| شعاع واندروالانسی |
152 pm |
|---|
| متفرقه |
|---|
| ساختار کریستالی |
cubic |
|---|
| مغناطیس |
paramagnetic |
|---|
| رسانایی گرمایی |
(300 K) 26.58x10-3 W·m−1·K−1 |
|---|
| سرعت صوت |
(gas, 27 °C) 330 m/s |
|---|
| عدد کاس |
7782-44-7 |
|---|
| پایدارترین ایزوتوپها |
|---|
| مقاله اصلی ایزوتوپهای اکسیژن |
| iso | NA | نیمه عمر | DM | DE (MeV) | DP |
|---|
| 16O |
99.76% |
16O ایزوتوپ پایدار است که 8 نوترون داردs |
| 17O |
0.039% |
17O ایزوتوپ پایدار است که 9 نوترون داردs |
| 18O |
0.201% |
18O ایزوتوپ
پایدار است که 10 نوترون داردs |
|
| |

عکسی از جوزف پریستلی کاشف اکسیژن
اکسیژن (به پارسی سره: ترشمایه[نیازمند منبع]) (به فارسی افغانستان: اکسیجن) یکی از عناصر شیمیایی در جدول تناوبی است که نماد آن O و عدد اتمی آن ۸ است. یک عنصر زیستی بوده و همه جا چه در زمین و چه در کل جهان هستی یافت میشود. مولکول اکسیژن (O۲)در زمین از نظر ترمودینامیکی ناپایدار است ولی توسط عمل فتوسنتز باکتریهای بی هوازی و در مرحله بعدی توسط عمل نور ساخت گیاهان زمینی به وجود میآید.
محتویات
- ۱ ویژگیها
- ۲ کاربردها
- ۳ پیشینه
- ۴ پیدایش
- ۵ ترکیبات
- ۶ ایزوتوپها
- ۷ هشدارها
- ۸ منابع
ویژگیها
اکسیژن در دما و فشار استاندارد به صورت گاز است که حاوی دو اتم اکسیژن به فرمول شیمیایی O۲ است. اکسیژن عنصر مهم هوا است و از طریق عمل فتوسنتز گیاهان تولید شده و برای تنفس حیوانات لازم است. واژه اکسیژن در دو واژه یونانی Oxus(ترش) و Gennan (زایش) ساخته شده است یعنی چیزی که از آن ترشی پدید میآید. در فارسی میتوان برای آن واژه ترشمایه[نیازمند منبع] را بکار برد. (برابرهای زبانهای دیگر برای واژه اکسیژن مثلآ آلمانی Sauerstoff و هلندی zuurstof هم دقیقآ همین معنی ترشمایه را میدهد). اکسیژن مایع و جامد رنگ آبی کمرنگ داشته و هر دو بسیار پارامغناطیس میباشند. اکسیژن مایع معمولاً با عمل تقطیر جزئی هوای مایع به دست میآید. درصد حجمی اکسیژن 21%است
کاربردها
اکسیژن به عنوان اکساینده کاربرد بسیار زیادی داشته، وتنها فلوئور از آن الکترونگاتیوتر است. اکسیژن مایع به عنوان اکسید کننده در نیروی حرکتی موشکها استفاده میشود. از آنجا که اکسیژن برای تنفس ضروری است در پزشکی کاربرد دارد. گاهی اوقات کسانی که کوه نوردی میکنند یا در هواپیما پرواز میکنند، مخازن اکسیژن همراه دارند (به عنوان هوا). اکسیژن در جوشکاری و ساخت فولاد و همچنین متانول نیز کاربرد دارد.
اکسیژن به عنوان یک ماده آرامش بخش، سابقه کاربرد دارد که تا زمان حال نیز ادامه دارد و بارهای اکسیژن در مهمانیها و بزمهای امروزی وجود دارد. در سده ۱۹ اکسیژن معمولاً با اکسید نیترات ترکیب میشد که اثر تسکین دهنده دارد.
پیشینه
اکسیژن در سال 1771 از سوی داروساز سوئدی کارل ویلهلم شیله کشف شد، ولی این کشف خیلی سریع شناخته نشد و با اکتشاف مستقل جوزف پریستلی به طور گسترده تری شناخته شد، و از سوی آنتوان لورن لاووزیه در سال ۱۷۷۴ نامگذاری شد.
پیدایش
اکسیژن فراوانترین عنصر در پوسته کره زمین است و برآوردهایی در این زمینه وجود دارد که مقدار آن را ۴۶٫۷% ذکر میکنند. اکسیژن ۸۷% اقیانوسها (به صورت آب ،H۲O)و ۲۰% درصد جو زمین (به صورت اکسیژن مولکولی، O۲، یا O۳، ازن) را به خود اختصاص میدهد. ترکیبات اکسیژن بویژه اکسید فلزات و سیلیکاتها (SiO۴۴-) و کربناتها
(CO۳۲-)معمولاً در خاک و تخته سنگها یافت میشوند. آب یخ زده یک جسم سخت متداول بر روی سیارات دیگر و ستارههای دنباله دار میباشد. کلاهکهای یخ کره مریخ از دی اکسید کربن منجمد تولید شده اند. ترکیبات اکسیژن در سراسر کهکشان یافت میشوند و طیف نور اکسیژن اغلب در ستارهها دیده میشود.
ترکیبات
الکترون به خاطر وجود الکترونگاتیویتی، اکسیژن تقریباً با تمام عناصر دیگر پیوند شیمیایی تشکیل میدهد(که این مطلب منشا تعریف اصلی اکسید شدن میباشد). تنها عناصری که تحت عمل اکسایش قرار نمیگیرند گازهای اصیل هستند. یکی از معروفترین این اکسیدها اکسید هیدروژن یا آب است H۲O. سایر اکسیدهای معروف دیگر ترکیبات کربن و اکسیژن هستند مانند دی اکسید کربن (CO۲)، الکلها (R-OH)، آلدئیدها (R-CHO) و کربوکسیلیک اسیدها (R-COOH). رادیکالهای اکسیژن مانند کلراتها
(ClO۳-)، پرکلراتها (ClO۴-)، کروماتها (CrO۴۲-)، دی کروماتها (Cr۲O۷۲-)، پرمنگناتها (MnO۴-)، و نیتراتها (NO۳-)، اکسایندههای قوی هستند. خیلی از فلزات مانند آهن با اتم اکسیژن پیوند برقرار میکنند اکسید آهن(Fe۲O۳).ازن (O۳)، با عمل تخلیه برق ایستایی (الکترواستاتیکی) در حضور مولکول اکسیژن شکل میگیرد. ملوکول اکسیژن دوتائی (O۲)۲ نیز شناخته شده، که از جزء کمی از اکسیژن مایع را تشکیل میدهد. اپوکسیدها و اترها موادی هستند که در آن اتم اکسیژن قسمتی از یک حلقه سه اتمی هستند.
ایزوتوپها
اکسیژن طبیعی مخلوطی از سه ایزوتوپ پایدار هست: اکسیژن-16 (99.759 درصد)، اکسیژن-17 (0.037 درصد) و اکسیژن-18 (0.204 درصد). اکسیژن ده ایزوتوپ پرتوزا نیز دارد. ایزوتوپهای پرتوزایی همه، نیمه عمری کمتر از سه دقیقه دارند. بیشترین نیمه عمر را اکسیژن-15 (124 ثانیه) دارد که در بررسی تنفس پستانداران استفاده می شود.
هشدارها
اکسیژن در فشارهای نسبی بالا میتواند سمی باشد.
قرارگرفتن طولانی در معرض اکسیژن خالص میتواند برای شش و سامانه عصبی سمی باشد. تأثیرات ریوی شامل آماس شش (ورم ریه) کاهش ظرفیت شش و آسیب به بافتهای ششی میباشد. تأثیرات بر سامانه عصبی شامل کاهش بینایی، تشنج و اغما میشود.
همچنین مشتقات خاصی از اکسیژن، مانند ازون (O۳)، پروکسید هیدوژن و رادیکالهای هیدروکسیل و سواکسیدها بسیار سمی میباشند. بدن سازوکارهایی را برای مقابله با این گونهها توسعه داده. برای نمونه، عامل طبیعی گلوتاتیون (glutathione) و بیلی روبین که فراورده بخش شدن طبیعی هموگلوبین است، میتوانند به عنوان یک پاداکسید (ضد اکسید) عمل کنند. منابع تمرکزیافته اکسیژن باعث احتراق سریع شده و بنابراین، در کنار فراوردههای سوختی خطر گسترش سریع آتش سوزی و انفجار وجود دارد.
آتشی که در مخازن اکسیژن آپولو ۱۳ رخ داد به این دلیل سریع گسترش پیدا کرد، که فشار جوی اکسیژن در حالت معمولی بود[نیازمند منبع]، در حالی که هنگام عملیات پرتاب این فشار باید یک سوم فشار جوی معمولی باشد. (ببینید فشار نسبی را).
منابع
- آزمایشگاه ملی لوس آلاموس - اکسیژن
- [oxygen. (2009). Encyclopædia Britannica. Ultimate Reference Suite. Chicago: Encyclopædia Britannica]
<td
| [نهفتن]
جدول تناوبی |
|---|
| H |
|
He |
| Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
| Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
| K |
Ca |
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
| Rb |
Sr |
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
| Cs |
Ba |
تاریخ : چهار شنبه 2 بهمن 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تاریخچه میکروسکوپ

در روزگاران قدیم، كوچكترین موجودات زنده ای كه مردم می شناختند آن هایی بودند كه به زحمت با چشم دیده می شدند. ولی آیا ممكن بود موجوداتی هم باشند كه با چشم دیده نشوند؟ اگر با چشم دیده نمی شدند، با چه وسیله ای ممكن بود آن ها را دید؟ البته در آن زمان هم مردم با وسایلی می توانستند كاری كنند كه ذرات خیلی كوچك، بزرگتر از آنچه بودند نشان داده شوند. مثلاً بعضی از مردم متوجه شده بودند كه اگر از میان شیشه ای كه سطح آن منحنی باشد به ذرات خیلی كوچك نگاه كنند، آن ها بزرگتر از آنچه هستند به نظر می آیند.
در حدود سال 1650 میلادی دانشمندان با این شیشه های منحنی به چیز های خیلی كوچك نگاه كردند و به دقت به بررسی آن ها پرداختند. اسم این شیشه ها را، كه سطح منحنی داشتند، عدسی گذاشتند. زیرا شكل آن ها مثل دانه های عدس بود. معمولاً برای اینكه به چیز های بسیار كوچك نگاه كنند، بیش از یك عدسی به كار می بردند و عدسی ها را در دو انتهای یك لوله ی فلزی جا می دادند. اسم ین لوله را، با عدسی هایی كه درون آن بود، میكروسكوپ گذاشتند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
کاربردهای نفت یا نفت خام
نفت یا نفت خام یکی از مهم ترین مواد موجود در جهان است. شناخته شده ترین محصولات فرعی نفت عبارتند از : سوخت های پر انرژی- گازوئیل یا بنزین - نفت چراغ- نفت دیزل و یا سوختهای نفتی و سوخت های گالنی نیز از نفت بدست می آیند . بیشتر غذاهایی که ما می خوریم و لباس هایی که می پوشیم تماما به نحوی از انحاء وابسته به مواد بدست آمده از نفت هستند . از نفت برای جلوگیری از چسبناک شدن نان به هنگام مخلوط کردن خمیر استفاده می شود . از نایلونهای نازک برای بسته بندی مواد غذایی استفاده می شود و بیشتر لباس های ما که از الیاف مصنوعی بدست آمده از نفت ساخته شده اند . بیش از یک هزار نوع روغن مایع و جامد از نفت خام ساخته شده اند. از روغن روان کننده در وسایل گوناگونی چون ساعت و قطعات ماشین آلات- لوکوموتیوها و مولد های برق استفاده میشود . آسفالت جاده ها و پشت بام ها نیز با استفاده از مواد نفتی ساخته می شود . موم بدست آمده از نفت در تولید اجناسی چون : شمع- کاغذ های روغنی و سلوفون استفاده می شود . مواد دیگری که از نفت بدست می آیند در تولید انواع کاغذ کاربن- مرکب چاپ کتاب وروزنامه و مواد پاک کننده مورد استفاده قرار می گیرد .

تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
اطلاعات اولیه اوسمیوم ، یکی از عناصر شیمیایی جدول تناوبی است که نماد آن Os و عدد اتمی آن 76 میباشد. یک فلز انتقالی سخت و شکننده به رنگ آبی متمایل به خاکستری یا آبی مایل به سیاه از خانواده پلاتین میباشد. اوسمیوم اگر سخترین فلز نباشد یکی از سخترین فلزهاست که در بعضی آلیاژها همراه پلاتین و ایریدیوم استفاده میشود. اوسمیوم به صورت غیرترکیبی به صورت آلیاژ در سنگ معدن پلاتین یافت میشود و تترواکسید آن برای رنگی کردن بافتها ( در آزمایشگاهها ) و در انگشت نگاری استفاده میشود. آلیاژهای اوسمیوم در نوک خودکارهای ساچمهای و نقاط تماس الکتریکی و مواردی که نیاز به دوام و سختی بالایی دارند، استفاده میشود. تاریخچه اوسمیوم که یونانی آن osme به معنی رایحه میباشد. در سال 1803 توسط "Smithson Tennant" در لندن به همراه ایریدیوم در کنار عمل حل پلاتین در تیزاب سلطانی ( Aqua Regia ) کشف شد. پیدایش این فلز انتقالی به صورت طبیعی در iridiosmium یک آلیاژ طبیعی ایریدیوم و اوسمیوم و در خاکهای رودخانه مملو از پلاتین ، در کوهای اورال و آمریکای شمالی و جنوبی یافت میشود. این فلز همچنین در سنگ معدنهای نیکل دار ، در منطقه Sudbury , Ontario به همراه دیگر فلزات گروه پلاتین یافت میشود. اگر چه فلزات پلاتین در این معادن کم است، حجم بالای سنگ معدن نیکل فراوری شده ، بازیافت این فلز را نظر اقتصادی با صرفه میسازد. خصوصیات قابل توجه اوسمیوم به شکل فلز بوده و درخشان در دمای بالا میباشد. این فلز بسیار شکننده بوده ، با چگالی بسیار زیاد به رنگهای آبی و سفید میباشد. اما ساخت این فلز به صورت غیر طبیعی بینهایت دشوار میباشد. ساختن پودر اوسمیوم سادهتر میباشد، ولی پودر اوسمیوم وقتی در معرض هوا قرار بگیرد، تترواکسید اوسمیوم ( OsO4) را که ماده ای بسیار سمی است، شکل میدهد. اکسید آن همچنین یک ماده اکسید کننده قوی بوده و بوی شدیدی دارد و در دمای 130 درجه سلسیوس به جوش میآید. اوسمیوم به خاطر چگالی بالای آن معمولا به عنوان سخترین فلز که حتی از ایریدیوم هم سختتر است، شناخته میشود. البته محاسبات در شبکه فضایی از محاسبات معمولی که چگالی kg/m3 22650 را به ایریدیوم و kg/m3 22661 را به اوسمیوم اختصاص میدهد، دقیقتر بوده و نتایج مورد اطمینانتری را ارائه میدهد. بنابراین در حال حاظر نمیتوان یک مرز مشخصی را از نظر چگالی برای اوسمیوم و ایریدیوم قائل شد، چرا که آنها کاملا به هم نزدیک هستند. این فلز در میان خانواده پلاتین بیشترین دمای ذوب و پایینترین فشار بخار را داراست. حالتهای اکسیداسیون معمولی اوسمیوم +4 و +3 میباشد، ولی حالتهای اکسیداسیون +1 تا +8 نیز مشاهده شده است. کاربردها از آنجا که اکسید این فلز بینهایت سمی میباشد، بهندرت بهصورت خالص از آن استفاده میشود و اغلب به صورت آلیاژ با دیگر فلزات در مواردی که نیاز به دوام بالا دارند، کاربرد دارد. آلیاژ اوسمیوم به همراه دیگر فلزات پلاتین بسیار سخت بوده و در مواردی که نیاز به آلیاژهای سخت دارند، مانند نوک خودکار ، سوزنهای گرامافون ، لوله ، محور ابزار ، لوازم گوناگون و اتصالات الکترونیک کاربرد دارد. تترو اکسید اوسمیوم برای تشخیص اثرانگشت و رنگ کردن بافتهای چرب برای اسلایدهای میکروسکپی کاربرد دارد. آلیاژ 90% پلاتین و 10% اوسمیوم در کاشتهای جراحی مانند ضربان ساز و جایگزینی دریچه های ریوی استفاده میشود.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
کاربرد های انرژی هسته ای
سالهای سال است که استفاده از ایزوتوپهای مواد رادیواکتیو در بدست آوردن اطلاعات از گذشته، اندازه گیری های صنعتی، کنترل کیفی محصولات، تغییر ویژگیهای محصولات و ... کاربرد دارد. خصیصه اصلی که باعث استفاده از این نوع مواد در صنعت می شود ویژگی پرتو افکنی مواد رادیو اکتیو است که در اینجا به برخی از این کاربردها اشاره می کنیم. لازم به ذکر است که مواد رادیو اکتیوی که در این گونه از موارد استفاده می شود، بسیار ضعیف و با طول عمر بسیار کم است، بگونه ای که هیچگونه خطری را متوجه انسان نمی کند.
اندازه گیری ضخامت
از آنجایی عبور پرتوهای رادیو اکتیو از مواد بتدریج باعث کاهش انرژی آنها می شود، با ساخت دستگاه های اندازه گیری دقیق انرژی می توان ضخامت اجسامی را که این پرتوها به آن تابیده می شود را اندازه گیری کرد. از همین خاصیت می توان برای مشخص کردن کیفیت برخی از مواد یا اجناس تولیدی که آیا ترک و شکستگی دارند یا خیر نیز استفاده کرد.

اندازه گیری سرعت
استفاده از مقادیر بسیار کم و ضعیف از مواد رادیو اکتیو در کنترل پروسس های تولید محصولات تقریبآ کاری عادی در تمامی کشورهای صنعتی جهان است. برای مثال افزودن مقدار کمی از این مواد به مایعی که از درون شبکه لوله ای به هم پیچیده عبور می کند، اجازه می دهد تا بسادگی بتوان با اندازه گیری تشعشعات از بیرون لوله، پی به سرعت مایع درون لوله و از آنجا دبی مایع پی برد.
برای دیدن بقیه ی مطلب به ادامه ی مطلب بروید.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
زندگی نامه ی دیمیتری ایوانوویچ مندلیف
کمتر کسي است که با جدول تناوبي مندليف در دروس شيمي آشنايي نداشته باشد و حداقل نام اين جدول را شنيده و ديده است. اين جدول به شيميدانان تا کنون کمک هاي شاياياني کرده است، زيرا همه عناصر موجود و کشف شده، وزن و نوع خاصشان توسط دانشمند مشهور روسي، ديميتري ايوانويچ مندليف طبقه بندي شده است. اين دانشمند برجسته توانست با تبحر کافي در شيمي به خواص عناصر مختلف دست يابد و آن ها را به همگان معرفي کند. در اين مقاله به زندگي پر فراز و نشيب اين شيميدان اشاره مي کنيم تا اطلاع کامل در زمينه نحوه زندگي و تلاش هاي مستمر او به دست آوريد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
زکزیای رازی
نام وی محمد و نام پدرش زکریا و کنیهاش ابوبکر است. مورخان شرقی در کتابهایشان او را محمد بن زکریای رازی خواندهاند، اما اروپائیان و مورخان غربی از او به نامهای رازس Rhazes و رازی Al-Razi در کتابهای خود یاد کردهاند. به گفته ابوریحان بیرونی وی در شعبان سال ۲۵۱ هجری (۸۶۵ میلادی) در ری متولد شده و دوران کودکی و نوجوانی و جوانیاش دراین شهر گذشت .
نام وی محمد و نام پدرش زکریا و کنیهاش ابوبکر است. مورخان شرقی در کتابهایشان او را محمد بن زکریای رازی خواندهاند، اما اروپائیان و مورخان غربی از او به نامهای رازس Rhazes و رازی Al-Razi در کتابهای خود یاد کردهاند. به گفته ابوریحان بیرونی وی در شعبان سال ۲۵۱ هجری (۸۶۵ میلادی) در ری متولد شده و دوران کودکی و نوجوانی و جوانیاش دراین شهر گذشت. چنین شهرت دارد که در جوانی عود مینواخته و گاهی شعر میسروده است. بعدها به کار زرگری مشغول شد و پس از آن به کیمیاگری روی آورد، وی در سنین بالا علم طب را آموخت. بیرونی معتقد است او در ابتدا به کیمیا اشتغال داشته و پس از آنکه در این راه چشمش در اثر کار زیاد با مواد تند و تیز بو آسیب دید، برای درمان چشم به پزشکی روی آورد. . در کتابهای مورخان اسلامی آمدهاست که رازی طب را در بیمارستان بغداد آموختهاست، در آن زمان بغداد مرکز بزرگ علمی دوران و جانشین دانشگاه جندی شاپور بودهاست و رازی برای آموختن علم به بغداد سفر کرد و مدتی نامعلوم در آنجا اقامت گزید و به تحصیل علم پرداخت و سپس ریاست بیمارستان معتضدی را برعهده گرفت. پس از مرگ معتضد خلیفه عباسی به ری بازگشت و عهدهدار ریاست بیمارستان ری شد و تا پایان عمر در این شهر به درمان بیماران مشغول بود. رازی در آخر عمرش نابینا شد، درباره علت نابینا شدن او روایتهای مختلفی وجود دارد، بیرونی سبب کوری رازی را کار مداوم با مواد شیمیایی چون بخار جیوه میداند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

ماری كوری در سال 1867 با نام ماریا اسكلو دووسكا در ورشو پایتخت لهستان متولد شد او در سن 19 سالگی به پاریس رفت تا در آنجا به تحصیل در رشته شیمی بپردازد . در آنجا با فیزیكدان جوان فرانسوی به نام پیر كوری آشنا شد و این آشنایی به ازدواج انجامید.
ماری كوری در سال 1867 با نام ماریا اسكلو دووسكا در ورشو پایتخت لهستان متولد شد او در سن 19 سالگی به پاریس رفت تا در آنجا به تحصیل در رشته شیمی بپردازد . در آنجا با فیزیكدان جوان فرانسوی به نام پیر كوری آشنا شد و این آشنایی به ازدواج انجامید. او به پیر كوری در انجام آزمایشهای عملی اش درباره الكتریسیته كمك می كرد زمانی كه او در سال 1895 در انباری چوبی كوچك كه آزمایشگاه او بود شروع به كار كرد نه او و نه هیچ كس دیگر چیزی درباره عنصر شیمیایی رادیم نمی دانست این عنصر هنوز كشف نشده بود البته یكی از همكاران پژوهشگر پاریسی فیزیكدان فرانسوی «هانری بكرل» در آن زمان تشخیص داده بود كه عنصر شیمیایی اورانیوم پرتوهایی اسراسر آمیز نامرئی از خود می افشاند او به طور اتفاقی یك قطعه كوچك از فلز اورانیوم را بر روی یك صفحه فیلم نور ندیده كه در كاغذ سیاه پیچیده شده بود گذاشته بود صبح روز بعد مشاهده كرد كه صفحه فیلم درست مثل این كه نور دیده باشد سیاه شده است بدیهی بود كه عنصر اورانیوم پرتوهایی را از خود ساطع كرده بود كه از كاغذ سیاه گذشته و برصفحه فیلم اثر كرده بود. بكرل این فرایند را دوباره با سنگ معدنی موسوم به (Pitch-blende) كه سنگی سخت و سیاه قیرگون است كه از آن اورانیوم به دست می آید- تكرار كرد این بار اثری كه سنگ بر روی صفحه فیلم گذاشته بود حتی از دفعه قبلی هم قوی تر بود بنابراین می بایست به غیر از عنصر اورانیوم یك عنصر پرتوزای دیگر هم در سنگ وجود می داشت او فرضیه خود را با خانواده كوری كه با او دوست بودند مطرح كرد آنها نیز این راز را هیجان انگیز یافتند این چه پرتوهای نادری بودند كه در اشیایی كه پرتوهای نوری معمولی از آنها عبور نمی كرد نفوذ می كردند و از میان آنها می گذشتند؟
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
آلفرد نوبل

آلفرد در ٢١ اکتبر سال ١٨٣٣ در کشور سوئد به دنیا آمد. او توانست در سن پطرزبورگ تحصیل کند. وی بسیار با استعداد بود. پدرش امانوئل نوبل از جمله مخترعانی بود که توانست یک مین زیردریایی بسازد. به همین دلیل به درخواست دولت روسیه که مینها را خریداری کرده بود، به سن پطرزبورگ نقل مکان کرد. آلفرد نوبل در سال ١٨٥٠ به آمریکا رفت و در آنجا نزد اریکسن مشغول به تحصیل شد. وی در مدت اقامتش در آمریکا دائم به این مسئله فکر میکرد که آیا میشود با اختراع یک ماده منفجر کننده میتوان از زحمت و رنج هزاران کارگر کاست یا نه. این موضوع همیشه فکر او را به خود مشغول میکرد. این شیمیدان بزرگ و ارزشمند سوئدی که در نهایت در سال ١٨٦٦ توانست دینامیت را کشف کند، نتواست به مردم بگوید که نباید از این ماده برای کشتن و مقاصد جنگی استفاده کرد.
با این اختراع نوبل در زمان بسیار کمی و اندکی، میلههای دینامیت جای ترکیبات بسیار خطرناک نیتروگلسیرین را گرفت. او اختراع خود را به ثبت رسانید و البته با فروش آنها نوانست ثروت بزرگ و هنگفتی بدست بیاورد. دینامیت سیما و چهره غرب را دگرگون کرد. از این ماده منفجره هم در موارد صلحجویانه و هم در ضمینه ویران و تخریب تمدن بشری میشد استفاده نمود. به خاطر کاربرد ناصحیح و غلط این ماده توسط بعضی کشورها او در بین مردم به عنوان یک مخترع بدشگون و بدخیم شناخته میشد.

آنها میگفتند که او معلومات و دانش خود را درجهت کشف وسایل ویرانگر و نابودکننده مورد استفاده قرار داده است. شناخته شدن این وسیله (دینامیت) و کاربرد نادرست آن در جنگها و ویرانگریها و کشتن انسانها توسط بعضی کشورها نوبل بشیمان شد و برای آن که بتواند آن را جبران کند، به هنگام مرگ وصیت نمود که تمامی ثروت و دارایی خود را که شامل ٣١ میلیون کرون سوئدی میشد، به عنوان جایزه سالیانه به بهترین و برگزیدهترین شاعر، نویسنده و به تمامی کسانی که در یکی از رشتههای شیمی، فیزیک، زیستشناسی، پزشکی و یا در ضمینه صلح جهانی خدمتی کرده باشند و یا کشفی ارائه داده باشند، به طور مساوی تقسیم گردد. این جایزه شامل دیپلم اقتخار و مدال طلا و چکی است که مبلغ آن، بستگی به سود بنیاد نوبل در آن سال دارد. در سال ١٩٦٨ بانک دولتی سوئد جایزه نوبل در رشته اقتصاد را نیز به آن اضافه نمود. از آن سال به بعد همه ساله این کار انجام میشود و در سالهای اخیر اعتبار بیشتری پیدا کرده است و برگزیدگان بیشتر به جنبه علمی و تخصصی آن افتخار میکنند. آلفرد نوبل در سال ١٨٩٦ در سان یو ایتالیا چشم از جهان فروبست.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تصاوير خارقالعاده دانشمندان از دنياي درون دانهها و بافتها
اين تصاوير عجيب ممکن است در ابتدا شما را از خوردن غذا باز دارد؛ اما در حقيقت، وعده غذايي ميتواند از يکي از 17 غذاي به تصوير کشيده شده توسط دانشمندان تشکيل شود.اين تصاوير خارقالعاده و عجيب در حقيقت غذاهايي از توتفرنگي و شکلات گرفته تا بروکلي و گل کلم هستند که در زير ميکروسکوپ بررسي شدهاند.
دانشمندان اين تصاوير را در پژوهشهاي آزمايشگاهي در مورد ترکيبات تشکيلدهنده غذاهاي روزانه به ثبت رساندهاند.
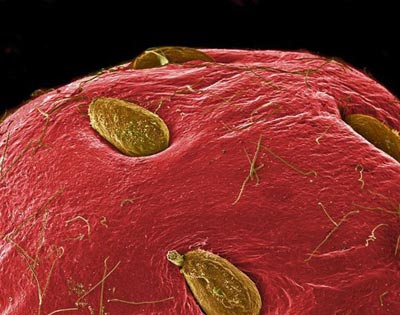
اسکن رنگي ريزنگار الکتروني از يک توتفرنگي
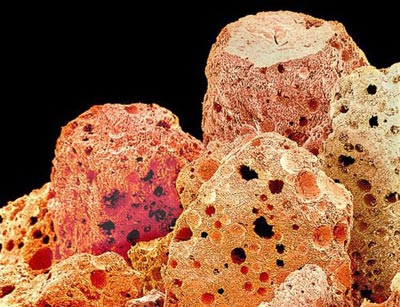
دانههاي قهوه با ساختار سنگي در زير ميکروسکوپ
تصوير نماي نزديک از يک دانه قهوه

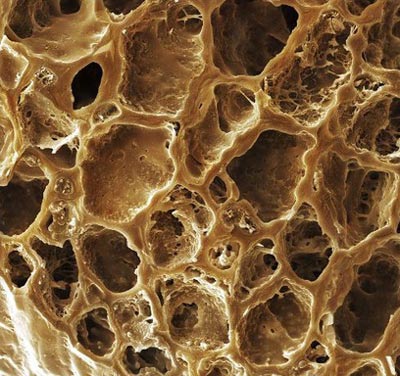
گلچه کلم بروکلي در تصوير ريزنگار که شبيه به يک گل لاله درآمده است
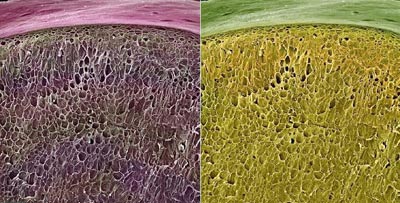
اسکن ريزنگار الکتروني از يک دانه انگور قرمز(چپ) و تصوير دانه انگور سفيد(راست)
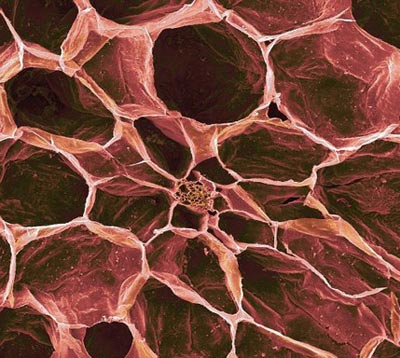
تصوير ميکروسکوپي از سطح سلولي گوجهفرنگي

تصوير نماي نزديک از دانه شکر(چپ) و شيرينکننده آسپارتام به شکل دانههاي شوره(راست)

پوسته باز و دانههاي يک فلفل تند
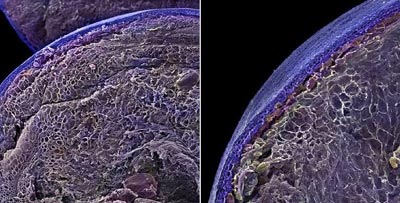
دو اسکن ريزنگار الکتروني از ساختار داخلي بلوبري

مرکز يک رازيانه ستاره اي خشک
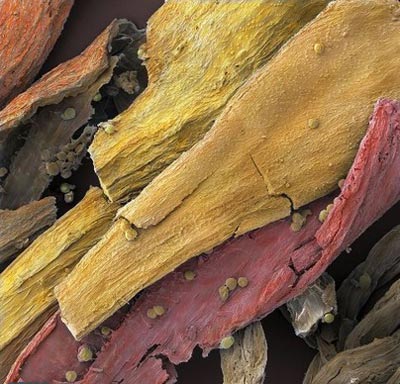
ريزنگار الکتروني رنگي از زعفران
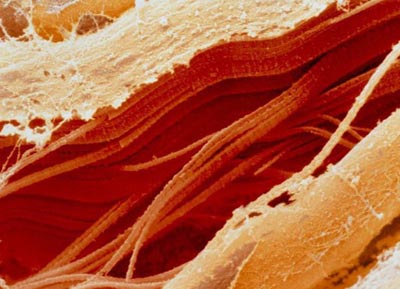
بافت گوشت خام با چربي
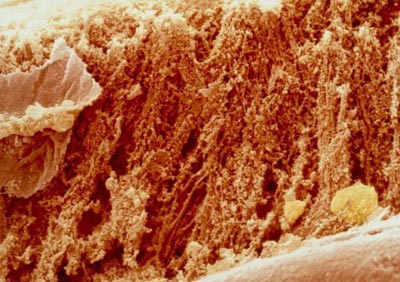
تصوير تغيير گوشت در فرآيند پخت

اسکن ريزنگار الکتروني از يک گلکلم

شکلات مغزدار نعنايي
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
سختی آلیاژ ها+جدول سختی آن ها
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

ویژگیها و خواص آب
مطلب را با اين اشاره آغاز می کنيم که آب تا به امروز، مهم ترين ماده سياره ما بوده است. و قسمت اعظم بدن همه موجودات زنده از آب ساخته شده است. بخش عمده مواد آلی آب است !در این مطلب به برخی از خواص آب اشاره میشود:
خواص آب
1. طبع آن سرد و تر است.
2.حدود 50 تا 75 درصد بدن انسان را آب تشکیل داده است.
3.بالا برنده انرژی الکترومغناطیسی بدن است.
4.باعث افزایش اکسیژن خون میگردد.
5.مفید در حفظ متابولیسم است.
6
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

اصطلاحات رایج هستهای چه مفاهیمی دارند
بعد از گذشت نزدیک به 12سال از بررسی پرونده هستهای کشورمان، اصطلاحات هستهای خیلی به گوش مردم کشورمان غریب نیست.
این نوشتار تلاش دارد تا به زبان ساده به توضیح برخی مفاهیم و اصطلاحات رایج هستهای بپردازد.
معاهده انپیتی چیست؟
معاهده انپیتی مشتمل بر 11ماده است که سهماده آن بیشترین چالش را بهدنبال داشته است. براساس ماده چهار حق تمامی کشورها برای توسعه فعالیتهای صلحآمیز هستهای به رسمیت شناخته شده و براساس ماده شش نیز باید تمامی کشورهای دارنده سلاح هستهای زمینه خلع سلاح را فراهم کنند و براساس ماده10 این معاهده نیز کشورها محق شناخته شدهاند هرگاه که احساس کردند مفاد معاهده برخلاف منافع ملیشان است از آن خارج شوند.
اهداف اصلی این معاهده چون خلع سلاح جهان، منع گسترش سلاحهای هستهای و استفاده صلحآمیز از انرژی هستهای، به مرور زمان منحرف شده است.
پادمان چیست؟
پادمان در فارسی بهمعنای نظارت و حراست کردن و اسم مصدری است که از ریشه فعل پاییدن گرفته شدهاست. پادمان امروزه در اصطلاح به مقررات نظارتی آژانس بینالمللی انرژی اتمی گفته میشود که شامل انواع بازرسیها میشود. از زمان تاسیس آژانس در سال۱۹۵۷، سامانه پادمانهای آن بهعنوان ابزار ضروری عدمتکثیر سلاحهای هستهای و همکاری صلحآمیز هستهای عمل کردهاست.
پیمان منع گسترش سلاحهای هستهای (NPT) انعقاد موافقتنامههای پادمانی (نظارتی) جامع با آژانس را توسط کشورهای عضو اجباری میداند. تاکنون سهنوع الگوی پادمانی توسط آژانس مورد تصویب قرار گرفته است؛ موافقتنامه پادمانی جامع معروف به سند ۱۵۳، موافقتنامه پادمانی۶۶ و پروتکل الحاقی۵۴۰.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
سانتريفيوژ چيست؟

سانتريفيوژ چيست؟
طي سال هاي گذشته و همزمان با پيشرفت هايي كه در زمينه استفاده از انرژي هسته اي صورت گرفته است ، مجموعه اي از مفاهيم و عبارات نيز وارد زبان روزمره فارسي شده كه اگر چه بارها در رسانه ها شنيده مي شوند،اما برخي از آنها در اذهان مردم شفافيت چنداني ندارند. يكي از اين عبارات "سانتريفيوژ" است.
سانتريفيوژ انواع و اقسام مختلفي داشته و استفاده از آن در بحث توليد انرژي هسته اي تنها يكي از موارد كاربردي آن است . شايد ساده ترين نوع استفاده از اين تكنيك ، ريختن سبزي هاي شسته شده در سبدي مخصوص و چرخاندن آن با استفاده از دستگيره و خارج نمودن آب اضافي از آنها باشد.
سانتريفيوژ به هر دستگاهي گفته مي شود كه با سرعت زيادي به دور خود چرخيده و در همين حال با استفاده از نيروي گريز از مركز ايجاد شده ، مواد درون خود را نيز به بيرون پرتاب مي كند.
بررسي اين فرايند در نوع خود كار ساده اي است . آزمايشي ساده مي تواند بسياري از علامت ها پرسش ها را از ميان بردارد . سطل آبي را برداشته و در حالي كه تا نيمه پر از آب است ، با سرعت به دور خود چرخانده و پس از چند دور پرتاب كنيد.
به خوبي ديده مي شود كه به واسطه نيروي گريز از مركز ايجاد شده ، آب درون سطل از آن بيرون نمي ريزد. اين امر ، پايه و اساس سيستم هاي سانتريفيوژ به حساب مي آيد .
در يك سانتريفيوژ واقعي نيز فرايند مشاهبي روي مي دهد . به واسطه چرخش بسيار سريع محفظه اي به دور خود، هر آن چه در درون آن وجود دارد به سمت بيرون تحت فشار قرار مي گيرد . اين دستگاه مي تواند در بر گيرنده هر ماده اي باشد ، از نمونه هاي خوني گرفته تا مواد شيميايي مختلف از اين رو نمونه هاي آن بسيار متنوع است .
به عنوان مثال ناسا داراي سانتريفيوژ عظيمي است كه از آن براي قرار دادن فضا نوردان در معرض نيروهاي شديد استفاده مي شود. نيروي گريز از مركز توليد شده در اين سانتريفيوژ مي تواند شبيه سازي بسيار مناسبي از نيروي گرانشي باشد كه در زمان پرتاب فضاپيماها بر بدن هوا نوردان وارد مي شود.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

کاربردهای جالب پوست تخممرغ که نمیدانستید
۱ - جلوگیری از گرفتگی لولههای فاضلاب: ریختن مقداری پوست خرد شده تخممرغ روی صافی فلزی سینک، باعث تمیزی و جلوگیری از گرفتگی لولهها میشود. آنها همچنین مانع از عبور مواد جامد و رهایی از چربیهای داخل لولهها میشوند.
۲ - به عنوان پاککننده: مقداری از پوست تخممرغ را همراه با پودر ظرفشویی روی سطح لک شده بریزید و با اسفنج آن را تمیز کنید.
در صورتی که بخواهید داخل ظرفی دردار را تمیز کنید، میتوانید مقداری پوست تخممرغ خرد شده را داخل ظرف ریخته، آن را با آب سرد تقریبا پر کنید و چندین بار تکان دهید. نتیجه فوقالعاده خواهد بود.
۳ - تمیز کردن لباسهای سفید: اگر از خاکستری شدن لباسهای سفید خود نگرانید، کافیست مقداری پوست تخممرغ داخل صافی ریخته، همراه لباسها داخل ماشین لباسشویی قرار دهید.
۴ - حاصلخیز کردن خاک: پوست تخممرغ سرشار از کلسیم و سایر مواد معدنی است. برای حاصلخیز کردن خاک آن را به کمپوست اضافه کنید.
۵ - دفع آفات: حلزونها، کرمهای برگخوار و آفات را با پاشیدن مقداری پوست تخممرغ در اطراف باغ خود دور کنید.
۶ - تغذیه گیاهان: قبل از آبیاری گیاهان، مقداری پوست تخممرغ داخل آب ولرم ریخته، داخل ظرفی دردار در جای تاریک و خنک قرار دهید. بگذارید چند روز باقی بماند.
۷ - تامین کلسیم: با ریختن مقداری پوست تخم مرغ به کف گلدان گوجه فرنگی، فلفل و بادمجان، کلسیم مورد نیاز آنها را تامین کنید.
۸ - گلدان: از تخممرغهای شکسته برای کاشت دانه استفاده کنید. آنها تا زمان سبز شدن دانه به عنوان گلدان قابل استفادهاند.
۹ - غذای پرندگان: ریختن خردههای پوست تخممرغ نزدیک ظرف غذای پرندگان ماده در جذب کلسیم مورد نیاز آنها برای تخمگذاری موثر است.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
موارد مصرف طلا (کاربردهای طلا)
در درجه ی اول از طلا به منظور سکه زنی و تهیه ی شمش و پشتوانه ی ارزی استفاده می شود به طوری که در کشور های سرمایه داری رقمی حدود ۴۰۰۰۰ تن را شامل می شود. مقدار باقی مانده ی طلا در تولید لوازم مختلف به کار می رود که جواهرات زینتی در صدر آنها قرار دارد (۵۰%) . انواع سبز و سفید و زرد طلا در جواهرسازی مورد استفاده قرار می گیرد. به خاطر نرمی در جواهرسازی آن را مس، نقره، نیکل و یا پالادیم همراه می کنند.

شمش های طلا
عمدهترین موارد تقاضای طلا برای جواهرات، صنایع الکترونیک، دندانپزشکی، سرمایه گذاریهای جزیی و دیگر موارد است. تقاضای مشتری یکی از موارد تقاضای طلا است که مجموع سرمایه گذاریهای جزیی و تقاضا برای جواهرات را شامل میشود.
میزان تقاضای طلا برای مصارف دندانپزشکی و صنایع در طول سال تقریباْ ثابت است و تغییر خاصی را نشان نمیدهد ولی تقاضای طلا برای جواهرات در طول سال متغیر است بطوریکه در سه ماهه آخر سال بالاترین مقدار را نشان میدهد و در تمام کشورها بالاترین میزان تقاضای طلا در روزهای قبل از سال نو آنها است که بهدلیل مصرف در ساخت جواهرات میباشد.
اطلاعات موجود در سال ۱۹۹۵ معرف آن است که کشورهای آسیایشرقی و جنوبشرقی مجموعاْ با خرید ۱۱۲۶ تن طلا رکورددار تقاضای طلا در سطح منطقه بودهاند. این مقدار حدود ۴۰ درصد کل تقاضای جهانی طلا بود که دلیل عمده آن شکوفایی اقتصادی این منطقه از جهان در این سالها است. کشور هند با متوسط تقاضای ۷۰۰ تا ۸۰۰ تن طلا، در صدر کشورهای مصرف کننده طلا قرار دارد زیرا در هند طلا و جواهرات جایگاه ویژهای دارد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
آزمایش علمی انفجار قوطی فیلم
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
اطلاعات اولیه
تنگستن ( نام سابق آن wolfram ) ، عنصر شیمیایی است که در جدول تناوبی دارای نشان W و عدد اتمی 74 میباشد. تنگستن که عنصری است بسیار سخت و سنگین ، جزو فلزات انتقالی و به رنگ خاکستری مایل به آبی تا سفید در سنگهای معدنی بسیاری از جمله ولف رامیت و شیلیت یافت شده و از نظر خصوصیات فیزیکی نیرومند خود قابل توجه است. از نوع خالص آن بیشتر در مصارف الکتریکی استفاده میشود، اما ترکیبات و آلیاژهای فراوان آن کاربردهای بسیار زیادی دارد؛ ( بارزترین آنها افروزه های لامپ و آلیاژهای دیرگداز عصر فضا است).
تاریخچـــــه
فرضیه وجود تنگستن ( واژه سوئدی tung sten به معنی سنگ سنگین ) برای اولین بار در سال 1779 توسط "Peter Woulfe" مطرح شد. او ولف رامیت را مورد بررسی قرار داد ( که بعدها نام آن از نام Woulfe گرفته شد ) و نتیجه گرفت که آن باید حاوی ماده جدیدی باشد. سال1781 "Carl Wilhelm Scheele" اثبات نمود که میتوان از تنگستنیت یک اسید جدید را تولید کرد. Scheele و Berman پیشنهاد کردند که احتمال تهیه یک فلز جدید بوسیله کاهش اسید تنگستنی وجـــــــود دارد.
"Fausto Elhuyar" برادرش وجود اسیدی را در ولف رانیت کشف کردند که مشابه اسید تنگستنی بود. بعدها در همان سال این دو برادر از طریق کاهش این اسید با ذغال چوب موفق به جداسازی تنگستن شدند. آنها با کشف این عنصر مورد قدردانی قرار گرفتند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
اطلاعات اولیه
اورانیوم یکی از عناصر شیمیایی جدول تناوبی است که نماد آن ، U و عدد اتمی آن 92 میباشد. اورانیوم که یک عنصر سنگین ، سمی ، فلزی ، رادیواکتیو و براق به رنگ سفید مایل به نقرهای میباشد، به گروه آکتیندها تعلق داشته و ایزوتوپ 235 آن برای سوختراکتورهای هستهای و سلاحهای هستهای استفاده میشود.
معمولا اورانیوم در مقادیر بسیار ناچیز در صخرهها ، خاک ، آب ، گیاهان و جانوران از جمله انسان یافت میشود.
خصوصیتهای قابل توجه
اورانیوم هنگام عمل پالایش به رنگ سفید مایل به نقرهای فلزی با خاصیت رادیواکتیوی ضعیف میباشد که کمی از فولاد نرمتر است. این فلز چکشخار ، رسانای جریان الکتریسیته و کمی Paramagnetic میباشد. چگالی اورانیوم 65% بیشتر از چگالیسرب میباشد. اگر اورانیوم بهخوبی جدا شود، بشدت از آب سرد متاثر شده و در برابر هوا اکسید میشود. اورانیوم استخراج شده از معادن ، میتواند بهصورت شیمیایی به دیاکسید اورانیوم و دیگر گونههای قابل استفاده در صنعت تبدیل شود.
گونههای اورانیوم در صنعت
اورانیوم در صنعت سه گونه دارد:
- آلفا (Orthohombic) که تا دمای 667.7 درجه پایدار است.
- بتا (Tetragonal) که از دمای 667.7 تا 774.8 درجه پایدار است.
- گاما (Body-centered cubic) که از دمای 774.8 درجه تا نقطه ذوب پایدار است. ( این رساناترین و چکشخوارترین گونه اورانیوم میباشد.)
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
طلاعات اولیه
اکسیژن یکی از عناصر شیمیایی در جدول تناوبی است که نماد آن O و عدد اتمی آن 8 میباشد. این ماده ، یک عنصر حیاتی بوده و همه جا چه در زمین و چه در کل جهان هستی یافت میشود. مولکول اکسیژن (O2 )در زمین از نظر ترمو دینامیکی ، ناپایدار است، ولی توسط عمل فتوسنتز باکتریهای بیهوازی و در مرحله بعدی توسط عمل فتوسنتز گیاهان زمینی بوجود میآید.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تاریخچه
هیدروژن ( کلمه فرانسوی به معنی سازنده آب و واژهaونانی hudôr یعنی آب و gennen یعنی تولید کننده ) برای اولین بار در سال 1776 بوسیله "هنری کاوندیش" بعنوان یک ماده مستقل شناخته شده ، "آنتونی لاوازیه" نام هیدروژن را برای این عنصر انتخاب کرد.
تاریخ : پنج شنبه 26 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
زمین در پایان دنیا چگونه خواهد شد؟
ستارهدنبالهدار سیاه
به گزارش دیلیمیل، پروفسور جوکلینبلبرونل، دانشمند نجوم ادعا کرده است که محتملترین اتفاقی که میتواند رخ دهد، برخورد ستارهدنبال سیاه با زمین است.

پروفسور بل برونل اعتقاد دارد که اگر دنیا در بیست و یک دسامبر تمام شود، یک ستارهدنبالهدار باعث این کار خواهد بود.
ستارههای دنبالهدار سیاه ماننده همنوعان خود، از مقدار کمی برف و یخ و میزان زیادی غبار تشکیل شده است که به همین دلیل دیدن آن در فضا مشکل است.
این دانشمند، ادعا کرده است که تنها نقاط مرکزی برخورد ستاره با زمین آسیب جدی خواهند دید و دیگر نقاط جهان اتفاق خاصی رخ نخواهد داد. اما غبار بسیاری غلیظی سراسر زمین را فرا خواهد گرفت که میتواند باعث مرگ تدریجی انسانها شود.
طبق ادعای برونل، مقادیر بسیار غبار باعث ایجاد زمستان جاویدانی خواهد شد که تمام زمین را از نعمت خورشید محروم خواهد کرد.
تاریخ : شنبه 21 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
روشهای ایجاد باران مصنوعی از طریق بارور نمودن ابرها
مقدمه : بارور نمودن ابرها از مباحث قابل توجهی است که خصوصا در پی خشکسالی های اخیرکشورمان ایران ، از بحث های قابل توجه بوده و در این زمینه دولت نیز اقدامات ارزشمندی انجام داده و استانهایی راچون کرمان ، یزد ، فارس و خوزستان را نیز به عنوان پایلوت انتخاب و بودجه قابل ملاحظه ای را نیز برای این امر در نظر گرفته است .
باروری ابرها در واقع یک روند طبیعی است که در آن ابرها به بخار آب و سپس به باران تبدیل میشوند . برای ایجاد باران مصنوعی باید عواملی چون ابر ، رطوبت ، دما و سایر شرایط جوی فراهم باشد . در صورت مهیا بودن شرایط میتوان با بارور نمودن ابرها به شکل مصنوعی ، بارندگی را در یک دوره آماری به میزان 5 تا 25 درصد افزایش داد .
تاریخ : شنبه 21 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
خوارزمی ابو جعفر محمد بن موسی از دانشمندان بزرگ ریاضی و نجوم می باشد از زندگی خوارزمی چندان ا طلاع قابل اعتمادی در دست نیست الا اینکه وی در حدود سال 780 میلادی در خوارزم(خیوه کنونی) متولد شد شهرت علمی وی مربوط به کارهایی است که در ریاضیات مخصوصاٌ در رشته جبر انجام داده به طوری که هیچیک از ریاضیدانان قرون وسطی مانند وی در فکر ریاضی تاثیر نداشته اند اجداد خوارزمی احتمالاٌ اهل خوارزم بودند ولی خودش احتمالاٌ از قطر بولی ناحیه ای نزدیک بغداد بود. به هنگام خلافت ماموی عضو دارالحکمه که مجمعی از دانشمندان در بغداد به سرپرستی مامون بود، گردید خوارزمی کارهای دیونانتوس را در رشته جبر دنبال کرد و به بسط آن پرداخت خود نیز کتابی در این رشته نوشت.
.
تاریخ : شنبه 21 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
ایزوتوپ
الکترون ها در مدارهای مختلف به دور آن در حال چرخش هستند.هر هسته هم از پروتون و نوترون تشکیل شده است.تعداد پروتون های موجود در هسته تمامی اتم های یک عنصر یکسان است.تعداد نوترون های هسته می تواند بدون ایجاد تغیییر شیمیایی در عنصر متفاوت باشد.
صفحه قبل 2 3 4 صفحه بعد
|